学术咨询服务正当时学报期刊咨询网是专业的学术咨询服务平台!
发布时间:2018-08-28 14:58所属平台:学报论文发表咨询网浏览: 次
摘要: 以轮叶党参为试材,采用单因素试验和响应面法相结合的方法研究轮叶党参多糖提取的最佳条件,评价其体外抗氧化活性. 结果表明: 在超声功率 138 W,超声时间 14 min,超声温度 35 ℃条件下,轮叶党参多糖的平均得率为 12. 48% ; 轮叶党参多糖 CLPS1 具有
摘要: 以轮叶党参为试材,采用单因素试验和响应面法相结合的方法研究轮叶党参多糖提取的最佳条件,评价其体外抗氧化活性. 结果表明: 在超声功率 138 W,超声时间 14 min,超声温度 35 ℃条件下,轮叶党参多糖的平均得率为 12. 48% ; 轮叶党参多糖 CLPS1 具有较强的抗氧化能力,对 DPPH·,·OH,ABTS+ 有很好的清除能力,IC50分别为( 3. 04±0. 35) mg /mL、( 2. 494±0. 4) mg /mL 和( 3. 41±0. 59) mg /mL.
关键词: 轮叶党参; 多糖; 超声波; 响应面法; 抗氧化
多糖在天然药物中分布非常广泛,一些具有保健、营养作用的植物如人参、山药、五味子、地榆、刺五加、大枣等均含有大量多糖. 多糖类在生物合成反应与机体代谢过程,以及细胞增殖、病毒及细菌感染、激素激活、肿瘤细胞转移等许多基本生命代谢过程中起着非常重要的作用. 因此,该领域的研究一直备受关注,其中,活性多糖的抗氧化能力是目前研究的热点之一. 近年来,已有大量关于活性多糖抗氧化能力的报道. 虽然抗氧化活性体外评价简便易行,但每种评价方法都存在不足,因此,对于体外抗氧化活性的评价通常会选择几种方法.
轮叶党参( Codonopsis lanceolata Benth. et. Hook. f) 为桔梗科党参属多年生草质缠绕性藤本植物,是中国、日本和韩国广泛使用的传统民间药物,含有多种生物活性成分,包括多酚、单宁、生物碱、皂苷、精油、三萜和类固醇等[1]; 展现出多种药理活性,如抗氧化[2]、抑菌[3]、抗炎[4]和免疫调节活性[5]等; 此外,越来越多的药理学研究证明,轮叶党参提取物具有显著的抗癌效应[6-7]. 目前,轮叶党参多糖的提取方法只有水提取法,关于超声波等新的提取方法未见报道. 本文以轮叶党参多糖得率为指标,选用超声波提取,对超声功率、超声时间、超声温度进行优化; 同时,测定轮叶党参多糖的抗氧化活性,以期为开辟轮叶党参开发和筛选的新途径提供参考.
1 材料与方法
1. 1 材料与仪器
轮叶党参根,采自吉林省桦甸市林下. 2 a 生根部,5 月采收,流水洗净,阴干后粉碎,过 50 目筛后于干燥阴凉处贮藏备用; 纤维素酶,10 000 U/g,上海江莱生物科技有限公司; 95% 乙醇、葡萄糖、苯酚、浓硫酸等均为分析纯.
仪器: RE52CS-1 型旋转蒸发仪,上海亚荣生化仪器厂; TDL-5-R 型离心机,上海安亭科学仪器厂; LGJ12 冷冻干燥机,北京松源华兴科技发展有限公司; 7200 型可见分光光度计,尤尼柯有限公司; KQ-250A 型超声波反应器,昆山市超声仪器有限公司; WK-1000A 高速药物粉碎机,山东青州市精诚机械有限公司.
1. 2 试验方法
1. 2. 1 绘制葡萄糖标准曲线
将葡萄糖标准品于 105 ℃下干燥至恒重,精密称取 50 mg 置于 50 mL 的容量瓶中,加入蒸馏水溶解并定容至 50 mL,充分混匀; 精确吸取 5 mL,加入蒸馏水稀释并定容至 50 mL,此时配制的溶液即体积质量为 0. 1 mg /mL 的葡萄糖标准液.
吸取 0. 1,0. 2,0. 3,0. 4,0. 5,0. 6,0. 7,0. 8 mL 葡萄糖标准液置于不同试管中,分别加入蒸馏水补足 1 mL,配制成体积质量为 0. 01,0. 02,0. 03,0. 04,0. 05,0. 06,0. 07,0. 08 mg /mL 的葡萄糖液,加入 5% 苯酚 1. 6 mL 及浓硫酸 7. 0 mL,振荡摇匀后室温静置 30 min,在 490 nm 处测吸光度[8]. 同时,以蒸馏水显色做空白试验. 以 OD 为纵坐标,标准葡萄糖体积质量为横坐标绘制标准曲线,所得方程为 y = 0. 075 5x+0. 055 3,R2 = 0. 995 4.
1. 2. 2 轮叶党参多糖含量测定
将轮叶党参样品准确稀释适当倍数,吸取 1. 0 mL 待测溶液,加入 5% 苯酚 1. 6 mL 及浓硫酸 7. 0 mL,振荡摇匀后室温静置 30 min,在 490 nm 处测吸光度. 根据标准曲线计算多糖含量.
1. 2. 3 多糖提取及纯化干燥后的轮叶党参在超声功率为 138 W,超声时间为14 min,超声温度为35 ℃条件下经过乙醇沉淀法处理,减压干燥得到轮叶党参多糖. 多糖得率( % ) = 多糖质量( g) /原料质量( g) ×100% .
1. 2. 4 单因素试验
准确称取干燥后轮叶党参粉 5 g 加入到一定量的蒸馏水中,利用超声结合纤维素酶法浸提一定时间后,4 000 r/min 离心 20 min 取上清液,定容,测定吸光度.
1) 超声功率对轮叶党参多糖得率的影响. 超声功率分别为 100,120,140,160,180,200,220 W,超声时间为 30 min,超声温度为 40 ℃,在最适加酶量条件下提取,考察超声功率对轮叶党参多糖得率的影响,计算多糖得率.
2) 超声时间对轮叶党参多糖得率的影响. 超声时间分别为 5,10,15,20,25,30,35 min,超声温度为 40 ℃,在最佳超声功率下,考察超声时间对轮叶党参多糖得率的影响.
3) 超声温度对轮叶党参多糖得率的影响. 超声温度分别为 30,35,40,45,50,55,60 ℃,在其他因素最优条件下提取,计算多糖得率.
1. 2. 5 响应面试验
利用 BOX-Behnken 设计响应面试验. 在单因素试验的基础上,根据中心组合设计原理设计响应面试验. 以多糖得率 y 为响应值,以超声功率、超声时间和超声温度为影响因素,每个因素设置 3 个水平. 因素水平编码见表 1.表 1 响应面试验因素与水平 Tab. 1 Factors and levels of response surface methodology 水平因素 A: P( 超声) /W B: t( 超声) /min C: θ( 超声) /℃ -1 120 10 30 0 140 15 35 1 160 20 40
1. 2. 6 多糖分离纯化
通过 Sevag 方法除去样品中的蛋白质. 收集上清液,透析并冻干,得到党参总多糖 CLPS0; 通过离子交换色谱法进一步纯化多糖样品,使用 DEAE-纤维素柱,用蒸馏水和 NaCl 线性梯度( 0→0. 9 mol /L) 洗脱; 收集组分并通过苯酚-硫酸法监测; 通过凝胶过滤色谱法,使用 Sepharose CL-6B 柱( 用 0. 15 mol /L NaCl 洗脱) 进一步纯化收集多糖样品,得到 3 种主要活性组分多糖: CLPS1 为 0. 3 mol /L NaCl 洗脱,CLPS2 为 0. 6 mol /L NaCl 洗脱,CLPS3 为 0. 9 mol /L NaCl 洗脱. 蒸馏水部分为中性多糖,活性较弱. 经查阅文献可知,多糖的活性部位主要存在于酸性多糖,即 NaCl 洗脱部分; 而水洗脱部分为中性多糖,活性弱. 因此,本文只收集酸性多糖进行下一步研究.
1. 2. 7 多糖抗氧化活性测定
1) 总还原能力. 取 2. 5 mL 多糖样品溶液放入试管中,依次加入 pH 为 6. 7 的 2. 0 mL 磷酸盐缓冲溶液和 2. 5 mL 1% 六氰合铁酸钾溶液,于 50 ℃保温 20 min; 冷却后加入 2. 5 mL 10% 三氯乙酸,离心 10 min,转速为 3 000 r/min; 取 2. 5 mL 上清液,依次加入 2. 5 mL 蒸馏水和 0. 5 mL 的 0. 1% 三氯化铁溶液,混合均匀,反应 10 min,在 700 nm 波长处测定吸光度[9].
2) DPPH·清除率. 用无水乙醇配置 0. 1 mmol /L 的 DPPH 溶液,暗处保存; 吸取 2 mL 不同浓度的多糖溶液和 2 mL 0. 1 mmol /L DPPH 溶液加入到试管中,摇匀,放入暗室静止 30 min 后在 517 nm 波长处测定吸光度[10].
3) ABTS+ 清除能力. 将 140 mmol /L 过硫酸钾 88 μL 和 5 mL 7 mmol /L ABTS+ 混合,在暗室下静止 12 h 形成 ABTS+ 自由基储备液,用无水乙醇稀释到不同浓度; 取 0. 1 mL 多糖样品,加入 ABTS+ 自由基储备液 2 mL,充分摇匀,在 20 ℃下 6 min 内测定反应液在 734 nm 处的吸光度[11].
4) ·OH 清除能力. 配置不同体积质量的轮叶党参多糖样品溶液,分别加入 2 mL 的 9 mmol /L FeSO4 溶液,2 mL 的 8. 8 mmol /L H2O2 溶液,2 mL 的 9 mmol /L 水杨酸溶液和 2 mL 不同体积质量的多糖提取液,加入 H2O2,在 37 ℃下保温 30 min,以蒸馏水作为对照,在 510 nm 处测定吸光度[12].
1. 3 数据处理
试验数据采用均值±标准差( x 珋±s) 表示,采用 SPSS 软件分析数据,通过 Design-Expert V 8. 0 软件优化试验结果,进行回归分析及误差分析.
2 结果与分析
2. 1 单因素试验
2. 1. 1 超声功率对轮叶党参多糖得率的影响超声功率对轮叶党参多糖得率的影响见图 1.
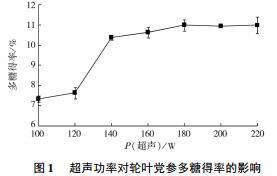
由图 1 可知: 随着超声功率的提高,多糖得率明显增加.当功率为 140 W 时,与 120 W 相比差异极显著( P<0. 01) ,轮叶党参多糖得率为 10. 37% ; 当超声功率超过 140 W 时,多糖得率没有明显变化( P>0. 05) . 由此说明,超声功率大于 140 W 时不会对多糖结构产生破坏,但考虑到时间和能耗问题,选择的最适超声功率为 140 W.
2. 1. 2 超声时间对轮叶党参多糖得率的影响超声时间对轮叶党参多糖得率的影响见图 2.
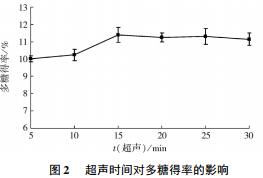
由图 2 可知: 超声时间在 5 ~ 15 min 时,随着超声时间的延长,轮叶党参多糖得率增加显著( P<0. 05) ,之后趋于平缓,变化不显著( P>0. 05) ,由此说明轮叶党参内部多糖已经全部释放出来,长时间作用会使多糖结构发生改变,导致多糖得率下降. 另外,长时间作用,杂质将增多. 考虑到经济成本及防止多糖遭受破坏,最佳超声时间选择 15 min/2f分钟对得到的数学模型进行方差分析、检验,见表 3.
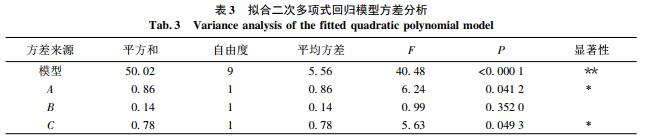
结果表明: 回归模型极显2著 P<0. 000 1,说明回归方程因变量和自变量之间的线性关系极显著; 失拟项 P = 0. 103 6 >0. 05,说明失拟因素对结果无影响; 复相关系数 R2 = 0. 981 0,说明该模型与试验值之间有较好的拟合度,模型可信度高,试验方法可行. 因此,回归方程能够较好地描述响应值和各变量之间的关系,可用以进行响应值预测.
由回归方程系数显著性检验可知: A2 ,B2 ,C2 极显著( P<0. 01) ,A,C,BC 为显著( P<0. 05) . 在各个因素中,按影响大小排序为 A>C>B. 最佳超声功率为 138. 12 W,超声时间为 14. 92 min,超声温度为 35. 76 ℃,调整后超声功率为 138 W,超声时间为 14 min,超声温度为 35 ℃.
为验证模型可靠性,利用优化条件进行验证试验. 在超声功率138 W,超声时间14 min,超声温度35 ℃ 下,轮叶党参多糖提取率预测值为 12. 46% . 在最优组合提取工艺条件下进行验证试验,结果显示: 3 次平行试验的平均得率为 12. 48% ,与预测值相比误差为 0. 15% ,模型可靠.
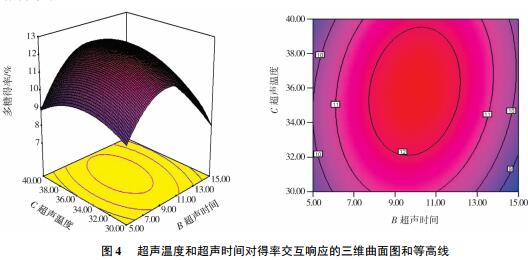
2. 2. 2 超声温度和超声时间交互作用
超声温度和超声时间对得率交互响应的三维曲面图和等高线见图 4. 由图 4 可见: 超声温度和超声时间之间存在显著的交互作用,并且超声温度对多糖得率的影响大于超声时间,随着超声温度和超声时间的增加多糖得率增加.
2. 3 轮叶党参多糖体外抗氧化活性
2. 3. 1 总还原能力
轮叶党参多糖的总还原能力见图 5. 由图 5 可见: 体积质量为 1 ~ 10 mg /mL 的多糖各组分表现出一定的还原力,并且体积质量为 1 ~ 2 mg /mL 的多糖总的还原能力随着多糖体积质量的增加逐渐增强; 在体积质量为 2 mg /mL 以后曲线趋于平缓,说明总还原能力增强幅度较小; 各组分多糖间存在差异,其中,CLPS1 组分与其他各组分存在显著差异( P<0. 01) .
2. 3. 2 对 DPPH·的清除能力
活性成分对 DPPH·清除率愈大表明该物质抗氧化能力愈强. 轮叶党参多糖对 DPPH·的清除能力见图 6. 由图 6 可见: 4 种轮叶党参多糖均表现出对 DPPH·具有清除能力,并且在体积质量为 0. 025 ~ 1. 000mg /mL 范围内随着多糖体积质量的增大而增强,随后趋于平缓,其中,CLPS1 清除 DPPH·的能力最强. CLPS1,CLPS2,CLPS3,CLPS0 清除 DPPH·的 IC50分别为( 3. 04±0. 35) mg /mL、( 3. 87±0. 36) mg /mL、( 5. 628± 0. 45) mg /mL、( 6. 066±0. 40) mg /mL. 由 IC50值可以看出,CLPS1 对 DPPH·清除能力的 IC50值最小
2.3. 3 对 ABTS+ 自由基的清除能力
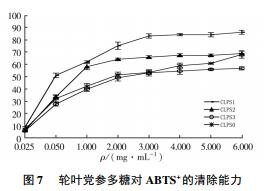
图 7 为轮叶党参多糖各组分对 ABTS+ 的清除能力. 由图 7 可见: 各组分均表现出一定的清除能力,并且随着多糖体积质量的增大,各组分多糖对 ABTS+ 的清除能力不断增强,其中,CLPS1 表现最为突出. 当体积质量为 6 mg /mL 时 CLPS1 对 ABTS+ 的清除率为 86. 15%,且和其他 3 组分差异极显著( P <0. 01) . CLPS1,CLPS2, CLPS3 和 CLPS0 的 IC50分别为( 2. 494±0. 4) mg /mL、( 3. 3 87±0. 53) mg /mL、( 5. 061 ±0. 704) mg /mL 和( 4. 33 ±0. 637) mg /mL. 试验结果表明,轮叶党参多糖各组分均具有清除 ABTS+ 的能力.图 8 轮叶党参多糖对·OH 的清除能力 Fig. 8 Scavenging ability of Codonopsis lanceolata polysaccharides on ·OH
2. 3. 4 对·OH 的清除能力
轮叶党参多糖对·OH 的清除能力见图 8. 由图 8 可见: 在所选体积质量范围内,随着体积质量的增大,轮叶党参多糖对·OH 的清除能力增强,并且所有的组分均表现出明显的清除能力,其中,CLPS1 对·OH 的清除能力与其他组分相比差异极显著( P<0. 01) . 当体积质量为 6 mg /mL 时对·OH 的清除率为 77. 67% ,其他 3 个组分间差异不显著( P>0. 05) . CLPS1,CLPS2, CLPS3 和 CLPS0 的 IC50 分别为( 3. 41 ±0. 59) mg /mL、 ( 4. 26±0. 63) mg /mL、( 4. 77 ±0. 68) mg /mL 和( 5. 88 ± 0. 77) mg /mL. 试验结果表明,轮叶党参多糖各组分均具有清除·OH 的能力.
结论与讨论
本次试验结果表明: 不同提取条件对轮叶党参多糖得率的影响由大到小依次为超声功率、超声温度和超声时间. 最佳工艺条件为超声功率 138 W,超声时间 14 min,超声温度 35 ℃,预测值为 12. 46% ,验证试验结果为 12. 48% ,误差小,表明模型可靠; CLPS1 对 DPPH·,·OH,ABTS+ 有很好的清除能力,随着 CLPS1 体积质量的升高,对自由基清除的能力增强,分离出的其他两种多糖 CLPS2,CLPS3 以及总多糖 CLPS0 抗氧化性均不及 CLPS1; 对总还原能力的测定结果表明,CLPS1 的还原能力大于其他组分.
从自然界中筛选活性物质是目前化学、生物学、药学等领域研究的重点内容之一,而多糖作为一大类天然产物越来越引起各界重视,实际上也确实发现了其具有强的生物活性,如香菇水提取物. 而对于未知多糖的活性认知是通过研究其抗氧化性开始的[13]. 其中,阻止某些链式反应的发生能够初步反映出其活性. 一些疾病和自由基密切相关,当人体超过清除自由基的负荷时将诱发各种疾病,如肿瘤的发生与迁移,机体衰老等. Fakhfakh N 等[14]通过体外抗氧化能力的测定发现锦葵多糖具有良好的抗氧化性. 轮叶党参多糖来源于轮叶党参干燥的根,目前对其研究还处在初级阶段,只对轮叶党参粗多糖的传统热水提取法提取条件进行了工艺筛选,未见到有关轮叶党参多糖纯化的报道,同时,对其活性的研究也只停留在混合组分多糖方面. 虽然已初步判断轮叶党参粗多糖对细胞迁移具有一定的抑制作用,但对单一组分的活性尚未有人揭示. 本次研究表明,轮叶党参多糖具有较好的抗氧化性,可以进行深入的研究与开发.
转载请注明来源。原文地址:http://www.xuebaoqk.com/xblw/3681.html
《超声波提取轮叶党参多糖工艺优化及抗氧化活性》